

来源:博药/小月石 发布时间:2022-04-19
在过去的60年里,威胁生命的传染病由于卫生条件的提升、疫苗和抗生素的发展,致死率正急剧下降,心血管疾病也因为一级和二级预防水平的提高危险性也正在降低,癌症悄然成为了致命的疾病之一。
根据世界卫生组织(WHO)数据,2020 年全球共有1929.2 万人被诊断出患有癌症,而 995.8万人因癌症失去生命。
但报告同时指出,通过早期筛查和治疗,约三分之一的患者可以预防肿瘤的发生,另三分之一患者的肿瘤将得到有效治疗。
美国食品药品管理局(FDA)作为全球药品监管机构的风向标,小编整理了2017-2021这五年美国FDA批准的抗肿瘤新药,供大家参考。
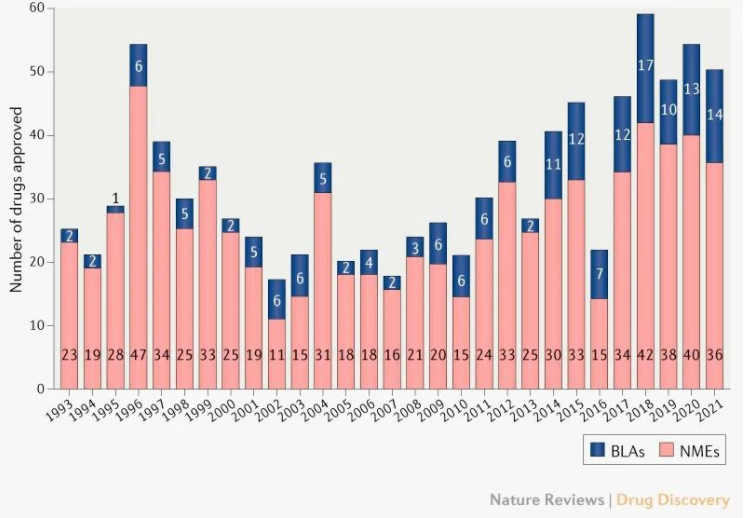
图1 1993年以来FDA批准的新药数量
来源:参考资料
据Nat Rev Drug Discov杂志文章统计,2017-2021年,FDA药物评估和研究中心(CDER)批准的新分子实体(NMEs)和生物制剂许可申请(BLAs)共256个,其中抗肿瘤新药抗癌疗法一直是大头,5年平均占比为28%。
这些抗肿瘤药物适应症包括卵巢癌、白血病、宫颈癌、肺癌、淋巴瘤、胆管癌、前列腺癌、子宫内膜癌、肾细胞癌、骨髓瘤、乳腺癌、胃肠道间质瘤、甲状腺瘤、黑色素瘤、肝细胞癌、膀胱癌、输卵管癌、腹膜癌、胰腺癌、尿路上皮癌等多种常见肿瘤及罕见肿瘤,分属小分子抑制剂、单克隆抗体、双特异性抗体、抗体药物偶联物等。
除了肿瘤治疗药物,还包括多款肿瘤诊断新药,例如成像药物Cytalux,可以帮助外科医生在手术中识别卵巢癌病变;放射性诊断剂Pylarify,用于识别疑似前列腺癌转移或复发。
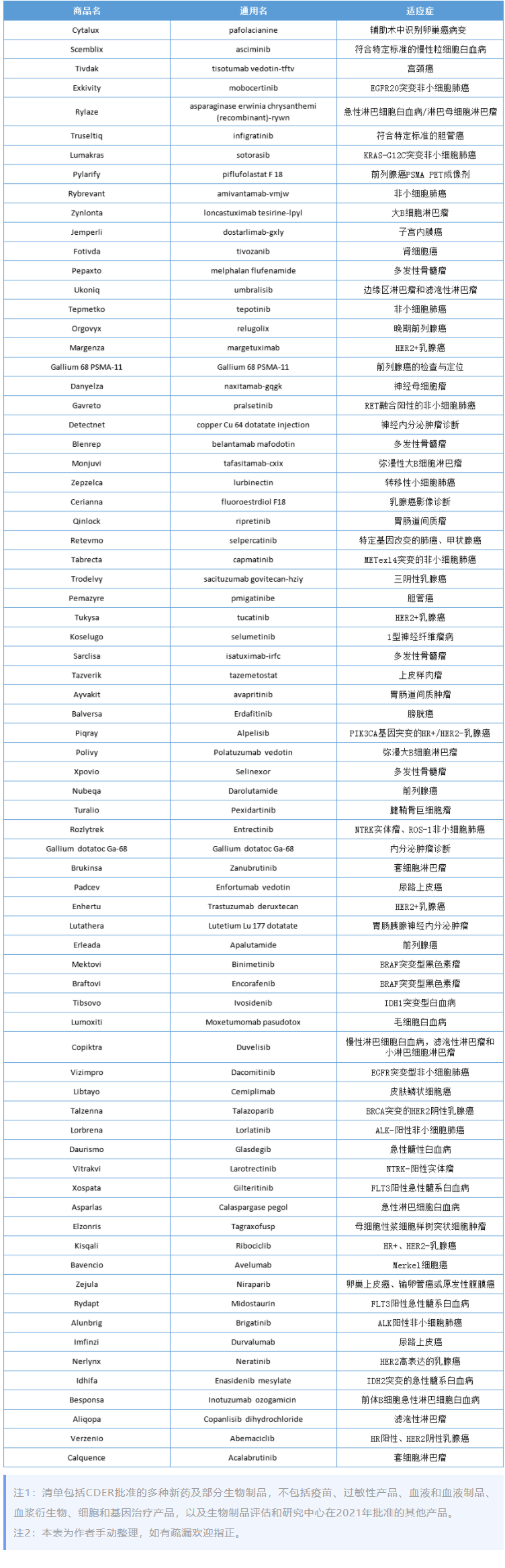
下面对部分获批抗肿瘤新药做简要介绍:
首个“不限癌种”靶向抗癌药:Vitrakvi
Vitrakvi(拉罗替尼,larotrectinib)是全球首个不区分肿瘤来源用于初始治疗的靶向药。该药的大看点在于,它是一款针对特定基因突变,而不针对特定癌症种类的抗癌新药。其所能治疗的NTRK基因融合实体瘤包括乳腺癌、结直肠癌、肺癌、甲状腺癌等几乎所有实体肿瘤类型,同时对成人和儿童都可以使用。2018年11月,Vitrakvi在美国获得全球首批,随后又在日本、欧盟等全球多个国家和地区获得批准。
2022年4月13日,中国国家药品监督管理局已批准larotrectinib的上市申请,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。
首个获得FDA批准的中国原研抗癌药:Brukinsa
Brukinsa(泽布替尼)是一款由百济神州科学家自主研发的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂。2019年11月,泽布替尼获得美国FDA加速批准,用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者。这一突破不但体现了中国医药公司在创新药研发能力方面的进步,也是中国监管机构不断改革,与国际标准接轨的成果。
截至目前,泽布替尼已在包括美国、中国、欧盟和英国、加拿大、澳大利亚和其他国际市场的40多个国家和地区获得20多项批准,还有40多项药政申报正在审评中。
首个获批的BCMA疗法:Blenrep
Blenrep(belantamab mafodotin-blmf)是一种抗体-药物偶联物(ADC),该药品是由人源化抗B细胞成熟抗原(BCMA)单克隆抗体和细胞毒药物澳瑞他汀F(auristatin F)通过不可切割的连接子偶联而成。2020年,美国FDA批准Blenrep作为单药疗法,用于治疗既往接受过至少4种疗法的复发性或难治性多发性骨髓瘤成人患者。目前,全球已有数十种BCMA疗法正在进行中,包括CAR-T疗法、双特异性抗体和抗体偶联药物等。
首个前列腺癌PET成像药物:Ga 68 PSMA-11
镓68 PSMA-11(Ga 68 PSMA-11)是首款用于在前列腺癌男性患者中针对前列腺特异性膜抗原(PSMA)阳性病变进行正电子发射断层扫描(PET)成像的药物。前列腺癌因早期症状不明显,患者容易忽视,约有一半的患者在确诊时已是晚期。之前的检测手段如直肠指诊、PSA检测、超声、穿刺活检、CT、MRI和骨扫描等在检测前列腺癌病变方面存在局限性。前列腺特异性膜抗原(PSMA)在绝大多数前列腺癌细胞中表达明显上调,且与病变的侵袭、转移、分期、分级、去势治疗抵抗、生化复发等密切相关,是理想的前列腺癌诊断标志物。Ga 68 PSMA-11的高敏感度和高特异度使前列腺癌的精准诊断成为现实。
首个获批的Trop-2 ADC:Trodelvy
Trodelvy(戈沙妥珠单抗)是一款同类首创的抗体与拓扑异构酶1抑制剂组成的抗体药物偶联物,靶点为TROP-2受体。2020年4月,Trodelvy获得美国FDA加速批准,用于先前已接受过至少2种疗法治疗转移性疾病的mTNBC成人患者。Trodelvy是FDA批准的第一个专门治疗复发或难治性mTNBC的ADC药物,也是FDA批准的第一个以Trop-2为靶点的ADC药物。
目前,Trodelvy在全球多个国家(包括美国、欧盟、澳大利亚、加拿大、英国、瑞士等)获批用于转移性三阴性乳腺癌的二线治疗。Trodelvy 在美国也获得加速批准用于治疗转移性尿路上皮癌患者,并继续被开发用于其他三阴性乳腺癌和转移性尿路上皮癌患者。在中国,该药由云顶新耀引进,2021年5月,中国国家药品监督管理局受理了Trodelvy的生物制品上市许可申请,并授予优先审评的资格。
首个KRAS靶向疗法:Lumakras
2021年5月,Lumakras在美国获批用于治疗先前已接受过至少一种系统疗法、经FDA批准的检测方法证实存在KRAS G12C突变、局部晚期或转移性NSCLC成人患者。这是经过近40年研究后获得批准的第一个KRAS靶向疗法,是第一个也是唯一一个被批准用于治疗携带KRAS G12C突变的局部晚期或转移性NSCLC患者的靶向疗法。
在中国,安进公司和百济神州已经达成合作,将共同进行Lumakras的开发工作。2021年1月底,该药获得了中国国家药品监督管理局药品审评中心(CDE)授予突破性治疗药物资格。
结 语
观看历史,人类与癌症的斗争已持续了几千年。从初的无法治疗,到寻找各种方法。虽然现在大部分癌症仍然无法实现临床“治愈”,但随着科学的进步和医学的发展,放/化疗、小分子靶向药物、抗体药物、细胞疗法等一代又一代的创新疗法相继问世,癌症治疗已迈向“精准治疗”新时代。相信有一天人类终将“消灭”癌症。
参考来源:
doi: https://doi.org/10.1038/d41573-022-00001-9