前沿
1型糖尿病(T1D)是一种复杂的T细胞介导的自身免疫性疾病,导致产生胰岛素的β细胞破坏和胰岛素分泌不足。在1921年发现胰岛素之前,T1D患者在确诊后一两年内就会死亡;然而,自从胰岛素的发现和大规模生产以来,T1D不再是一种绝症,然而,随着时间的推移,许多患者依然会出现并发症,包括心血管疾病、视网膜病变、神经病变和肾病。
T1D在发病到临床得到诊断之前,会经历几个阶段。实际上,在T1D诊断之前,免疫反应已经被触发,到得到诊断时,大量β细胞已经被胰岛自身抗原特异性T细胞破坏。然而,在诊断之前的几个阶段,患者机体会对胰岛抗原产生积极反应。这为在广泛的组织损伤之前潜在地干预和重置免疫系统提供了一个机会窗口。
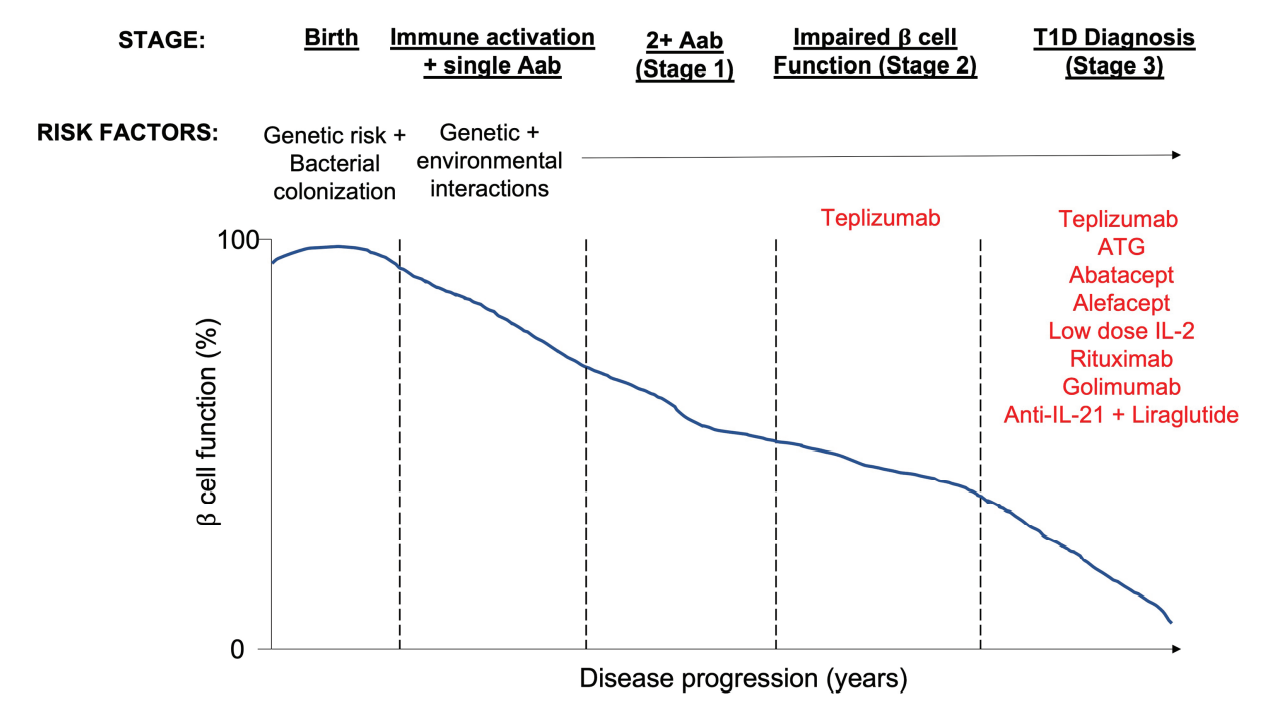
基于T1D大鼠模型的成功实验,早期的免疫调节尝试包括使用钙调神经磷酸酶抑制剂环孢霉素。在确诊后6周内接受治疗的30名患者中,16名恢复到正常的C肽水平,并成为胰岛素独立型,这是一个前所未有的结果。皮质类固醇加每日硫唑嘌呤的使用在新发T1D中也显示出有益的结果,尽管由于有副作用,这些方法没有被采用,但这些试验在证明T1D免疫调节的潜力方面仍然很重要。
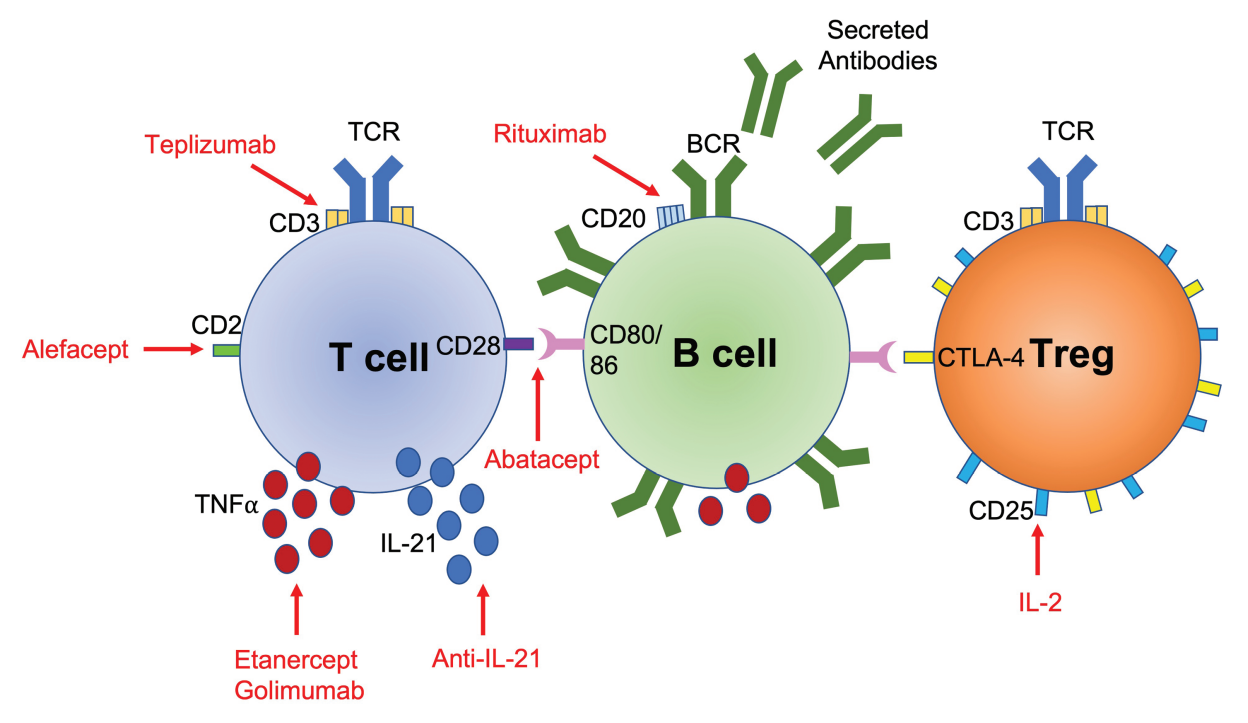
此后,已有多项免疫治疗研究旨在通过针对参与疾病过程的关键免疫细胞以及它们产生的细胞因子来减少β细胞的丢失。一些成功的非抗原特异性免疫疗法,在保护β细胞功能甚至延缓T1D发展方面展现出富有希望的前景。
靶向T1D中的T细胞
CD4+和CD8+T细胞协调炎症过程,终破坏胰岛β细胞,导致T1D的发生。许多与1型糖尿病易感性相关的基因在T细胞中是非常活跃的。T细胞浸润糖尿病患者的胰岛,在小鼠模型中,通过过继转移T细胞,糖尿病可以从一种动物转移到另一种动物。因此,针对T细胞的免疫疗法已经得到了广泛的关注。
抗CD3免疫疗法
1979年,Orthoclone(OKT3)被开发出来,靶向CD3受体的ε链。1981年,第一批患者服用OKT3,被证明能成功逆转同种异体移植排斥反应。1985年,OKT3开始商业化用于移植,使其成为第一个获批的单克隆抗体。然而,由于副作用,OKT3在临床上的应用受到限制。Teplizumab是一种改良的OKT3抗体,与OKT3具有相同的结合区域,但去掉了ADCC的功能。
临床前研究表明,短期抗CD3治疗能够诱导高达80%的新近诊断的糖尿病非肥胖糖尿病(NOD)小鼠病情缓解,这与短暂和部分T细胞耗竭有关。鉴于NOD小鼠抗CD3治疗的临床前研究取得了成功,Teplizumab在24名新诊断的T1D患者中进行了临床研究,在治疗12个月后,三分之二的Teplizumab治疗组的C肽反应相当于或高于研究开始时,而12名对照组参与者中有10人的C肽反应下降。类似地,对80例新发T1D患者进行的另一种人源化抗CD3抗体(Otelixizumab)的II期研究也显示,接受抗CD3治疗的患者的β细胞功能恶化较慢。
此外,胰岛自身抗体在糖尿病发生前多年产生的事实为治疗干预提供了机会。人们开始利用这一窗口,向患有血糖异常且存在2种或2种以上胰岛自身抗体但尚未被诊断为T1D的高危人群服用Teplizumab,这项研究成功地延缓了这些个体的T1D发展,与安慰剂组的28%相比,Teplizumab组的57%无糖尿病。一项长期随访研究(中位数为923天)发现,与安慰剂组的22%相比,Teplizumab治疗组的50%仍无糖尿病。这些数据改变了T1D免疫治疗的前景,提供了第一个证据,证明在高危人群中使用T细胞导向疗法可以改变未来的疾病进程。
这种干预在延缓T1D发展方面的成功是开创性的,Teplizumab很可能成为第一种获准用于延缓甚至预防T1D发展的免疫疗法。然而由于未积累足够的数据,FDA拒绝了2021年7月对Teplizumab批准的请求。但是,免疫疗法在T1D环境中获得批准的势头正在明显增强,而Teplizumab仍然处于领先地位。
抗胸腺细胞球蛋白(ATG)
ATG是一种多克隆IgG,靶向多种T细胞抗原并介导细胞耗竭。在NOD小鼠中,与抗CD3给药类似,ATG治疗能够逆转新近发病小鼠的糖尿病。对新近发病的T1D患者进行的初步小型研究表明,服用ATG可能有助于保护β细胞功能。
然而,在一项II期随机多中心安慰剂对照试验中,58名受试者在T1D诊断后100天内参与试验,ATG不能保留β细胞功能。这种失败与ATG治疗个体在基线到6个月之间的Treg与T效应记忆细胞比率下降有关。随后对25名T1D患者进行的一项试验使用了较低剂量的ATG,并结合粒细胞集落刺激因子(GCSF)治疗,这种方法似乎能保护β细胞,接受安慰剂治疗的受试者在一年内C肽减少39%,而接受ATG/GCSF治疗的受试者在同一时间段内C肽增加4.3%。
因此,低剂量ATG仍然是一个有趣的候选者。值得注意的是,在多个临床试验中比较β细胞保护干预的尝试发现,低剂量ATG和抗CD3免疫疗法是对C肽保护影响大的治疗方法。
Abatacept
T细胞定向免疫治疗的另一个例子是CTLA-4-Ig融合蛋白Abatacept。CTLA-4在调节性T细胞中自然高水平表达,它与T细胞共刺激受体CD28相同的配体相互作用,但以更高的亲和力与它们结合。
在对112名确诊T1D的患者进行了的临床试验中,Abatacept能够在估计的9.6个月内减缓β细胞破坏和功能的下降,与安慰剂相比,在治疗停止1年后,治疗组仍观察到较高的C肽水平。这种保护作用与CD4+中枢记忆T细胞群和B细胞群的减少,以及Treg和幼稚CD4+T细胞的增加有关。在新发T1D研究的基础上,Abatacept目前正在T1D风险人群中进行试验(NCT01773707)。
Alefacept
Alefacept是另一种Ig融合蛋白,包含两个LFA-3分子,与人IgG1的Fc部分结合。它与CD2结合,并介导有抗原经验的效应/记忆T细胞的耗竭。Alefacept通过依赖Fc受体结合的方式抑制混合淋巴细胞反应中T细胞的增殖。
在T1DAL研究中, 33名T1D患者接受了为期12周两个疗程的Alefacept治疗,16名患者接受了安慰剂治疗。但试验未达到主要终点,因为在12个月的2小时混合餐耐受试验(MMTT)中,C肽测量值之间的差异不显著(P=0.065);然而,在同一时间点在4小时MMTT中进行C肽测量的次要终点得到满足(P=0.019)。随访分析表明,停药15个月后,有益效果得以维持,Alefacept治疗组的C肽水平高于安慰剂治疗组,胰岛素需求量显著降低,低血糖发生率显著降低。
IL-2治疗
针对T细胞的另一种免疫治疗方法是使用细胞因子IL-2选择性扩增Treg。IL-2在免疫调节中的作用表明,IL-2或参与IL-2信号传导的基因缺陷与自身免疫性疾病(包括T1D)相关。使用IL-2抑制免疫反应是同一药物在不同剂量下用于相反目的的一个非凡例子,因为高剂量IL-2用于促进癌症患者的抗肿瘤反应。
在临床前模型中,低剂量IL-2能够扩大Treg并逆转已建立的1型糖尿病。然而,一项IL-2与雷帕霉素联合的人类I期研究给出了令人失望的结果:尽管Treg频率增加,但C肽暂时降低,这与NK细胞和嗜酸性粒细胞的增加相一致。有鉴于此,该领域朝着两个方向发展:一个涉及精细给药方案,以确定在不激活效应细胞的情况下激活Treg;另一个涉及产生突变IL-2,旨在避免NK细胞、嗜酸性粒细胞和效应T细胞的有害激活。
靶向T1D中的B细胞
B细胞也与T1D的发生有关。在动物模型中,B细胞缺乏或缺失会抑制糖尿病的发生。此外,B细胞也是有效的抗原呈递细胞,能够激活自身抗原特异性T细胞,从而导致糖尿病。研
利妥昔单抗与B细胞表面表达的CD20结合,通过抗体依赖性细胞介导的细胞毒性、凋亡和补体依赖性细胞毒性导致其破坏。利妥昔单抗对许多不同的自身免疫性疾病都有疗效,包括系统性红斑狼疮和类风湿性关节炎。
利妥昔单抗在新近发作的T1D患者中进行了试验。49人接受利妥昔单抗治疗,29人接受安慰剂治疗。主要观察指标是首次输注后1年MMTT中刺激的C肽水平。该临床试验的结果表明,去除B细胞明显有益:利妥昔单抗治疗组的平均C肽水平高出20%(利妥昔单抗组为0.56pmol/ml,安慰剂组为0.47pmol/ml),治疗还显著降低了糖化血红蛋白水平(6.76% vs 7.00%),并减少了所需的胰岛素剂量(0.39U±0.22/kg vs 0.48U±0.23/kg)。
靶向炎性细胞因子
IL-1β
IL-1β分泌随着糖尿病和胰岛β细胞破坏的进展而增加;然而,两项随机、双盲、安慰剂对照试验,分别给予Canakinumab(一种人类抗IL-1单克隆抗体)或Anakinra(一种人类IL-1受体拮抗剂),均未显示任何保护作用。这与IL-1受体或IL-1β缺陷型NOD小鼠的研究数据一致,在这些研究中未观察到对糖尿病发展的保护作用。类似地,在近一项针对新诊断T1D患者的试验中,阻断IL-6Ra似乎并没有带来益处。
TNF-α
TNF-α在一段时间以来一直是T1D的关注目标。对NOD小鼠的研究产生了复杂的结果,表明TNFα发挥着位点特异性、细胞类型特异性和年龄依赖性的作用。向新生小鼠注射抗TNF-α抗体可显著抑制糖尿病的发展,然而,如果在成年小鼠中开始治疗,保护作用就会减弱,并且给予TNF-α本身会加剧新生小鼠的疾病,但在成年小鼠中却相反地延迟了疾病的发生。
Etanercept是一种与TNF-α结合的重组可溶性TNF受体融合蛋白,在一项为期24周的随机、双盲、安慰剂对照可行性研究中,Etanercept的平均C肽水平比基线水平增加了39%,而安慰剂组的平均C肽水平下降了20%。近,Golimumab,一种先前被批准用于治疗类风湿性关节炎和溃疡性结肠炎的抗TNFα单克隆抗体,也在新诊断的T1D患者中进行了测试。在这项II期随机、双盲、安慰剂对照研究中,给药52周后,治疗组的C肽显著增加,胰岛素使用显著减少。
IL-21
IL-21作为T1D免疫治疗的靶点也具有一定的吸引力。IL-21是滤泡辅助性T细胞(Tfh细胞)产生的特征性细胞因子,为B细胞抗体的产生提供帮助,因此在体液免疫中发挥重要作用。
缺乏IL-21或IL-21受体的NOD小鼠可防止糖尿病的发生,而在胰岛中转基因表达IL-21足以在非自身免疫易感小鼠中诱导糖尿病。在一项对新近发病的T1D患者进行的II期随机双盲、双模拟、安慰剂对照研究种,分别比较了抗IL-21、抗IL-21联合利拉鲁肽、单独利拉鲁肽或安慰剂的治疗。研究发现,与安慰剂相比,所有治疗组的HbA1C均降低;然而,在抗IL-21与利拉鲁肽的联合治疗中,观察到MMTT后C肽的减少降低,表明联合治疗组与单一治疗组相比,β细胞功能增强。
微生物衍生疗法
肠道细菌组成等环境因素对形成免疫反应和调节T1D易感性非常重要。细菌成分的这些变化也与早期β细胞自身抗体反应的发展有关。
益生菌是一种对健康有潜在益处的细菌,也因其调节T1D易感性的作用而被广泛研究。在一项针对健康成年人的双盲随机试验中,L.johnsonii N6.2乳杆菌被证明是安全的,可诱导耐受性免疫反应。目前正在对患有T1D的儿童、青少年和成人进行研究,以确定其安全性、耐受性和有效性(NCT03961854和NCT03961347)。
目前,T1D的微生物衍生疗法领域仍处于早期发展阶段,需要更多的工作来确定是否可以利用它来调节免疫反应并提供长期临床益处。
小结
自从发现胰岛素以来的100年里,T1D仍然没有治愈的方法。然而,免疫治疗的前景正在逐渐开始实现,在预防和新发病环境中都有进展的早期迹象。前进中的关键挑战在于辨别哪些干预措施适合哪个疾病阶段,因此,更好地了解与诊断年龄相关的疾病类型,终将为个体对不同治疗方案的分层提供信息。使用生物标记物,如Tfh,或Treg和可溶性IL-2R来消除临床反应的异质性也将是关键。
随着有效的免疫疗法逐渐开始出现,重要的是建立机制,让更多的人可以选择参与T1D诊断的临床试验,以便对候选干预措施进行比较。结合识别高危人群的大规模举措,T1D治疗和预防的新格局正在开始形成。
参考文献:
1. 100 years post-insulin: immunotherapy asthe next frontier in type 1 diabetes. Immunother Adv. 2021 Jan; 1(1):ltab024.

