RNA疗法是指以RNA为基础药物或疫苗,用于预防或治疗疾病。自新冠疫情以来,mRNA新型疫苗凭借可快速设计、合成和制备,具备高效、灵活等多重优势,在传染病领域发挥了重要的作用。整个RNA疗法行业也因此进入全面加速期。
新药研发的另一种可能——RNA疗法
1958年,Crick首次在“中心法则”中将RNA描述为遗传信息传递的关键参与者,该理论后来通过mRNA的发现得到证实,亦证明了这些分子作为关键信使在翻译中包含着重要性遗传信息。
如今,RNA疗法已成为治疗人类疾病不可或缺的技术。
RNA疗法是指基于RNA的靶向治疗手段,药物终的靶点通常是特定的RNA序列,或者药物本身就基于RNA的分子。RNA疗法可以作用于靶向人和病毒的转录组、调节基因表达、改变mRNA剪切、靶向参与转录、以及通过表观遗传学途径调控非编码RNA和mRNA等。
RNA疗法的出现,颠覆了传统药物研发的逻辑思路。许多科学家相信,RNA在生物学中的作用是无限的,因而它的治疗潜力也是无限的。
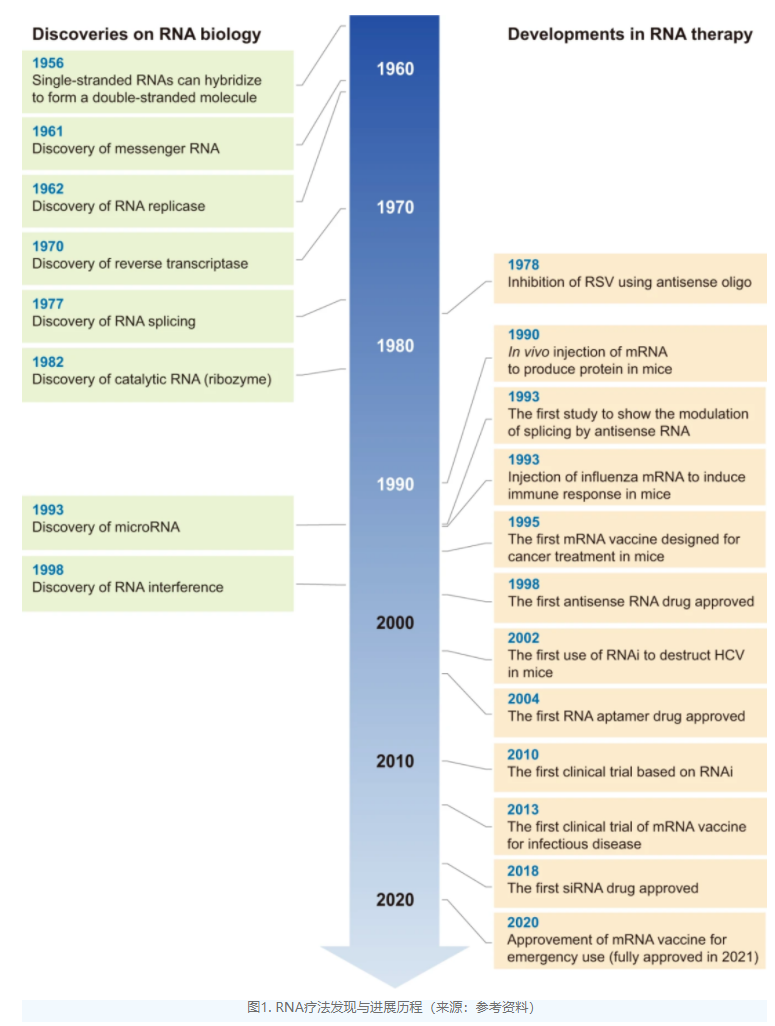
与传统的化学治疗药物相比,RNA疗法优势显著。
1.靶向“不可成药”靶标
RNA疗法大优势之一是能够靶向细胞内几乎任何基因成分,包括许多被认为是无法靶向的靶点,包括小分子和抗体。由于许多蛋白质具有相似的结构,直接靶向单一的特定靶蛋白并非易事。因此,以前的研究认为只有不到三分之一的人类蛋白质可以有效地被小分子靶向。然而,RNA疗法可以通过阻止这些蛋白质的生物发生,从而抑制它们的产生,达到治疗效果。
2.快速生产
开发生产新型小分子或抗体药物可能需要数年时间。然而,一旦确定了RNA的化学结构和递送到体内的方式,就可以快速设计和合成RNA药物用于临床试验。例如,在COVID-19大流行时,BioNTech和Moderna在新冠病毒序列发布后的短时间内就针对该病毒设计了mRNA候选疫苗,并快速将其应用于动物实验、临床试验。
3.具有长效性
虽然天然RNA很容易被核酸酶降解,但当对其进行修饰,再辅以特殊的递送系统后,RNA的稳定性会大大提高。
4.用于罕见病治疗
理论上,RNA疗法只要掌握致病蛋白的基因编发序列,就能设计出相应的RNA双链,靶向沉默蛋白的产生过程,研发成本将大幅降低。这对于很多罕见病有着天然的适应性。
5.无遗传毒性风险
与DNA疗法相比,RNA疗法没有明显的遗传毒性作用。
RNA疗法蓄势待发,国产力量加速崛起
虽然RNA疗法已经历数十年的发展,罗氏、辉瑞、雅培和默克都曾在21世纪初投入大量资金进行布局,但由于RNA很容易被降解,相关药物的早期临床试验并不尽如人意。
直到近几年,随着递送系统的技术突破,RNA疗法才逐步走向市场。尤其是2020年两款mRNA新冠疫苗的获批使RNA疗法获得了前所未有的关注。
表1.已获批的RNA药物
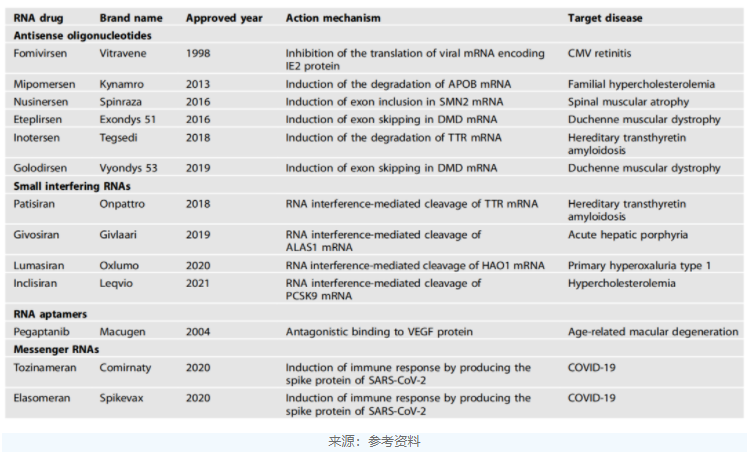
常见的RNA治疗手段按分子类型和作用方式的不同可分为反义寡核苷酸(antisenseoligonucleotide,ASO)、小干扰核糖核酸(smallinterferingRNA,siRNA)、适配体(aptamer)和信使核糖核酸(mRNA)。
ASO
反义寡核苷酸药物是发展早、获批药物多的RNA药物。ASO通过结合到特异性序列以调节靶RNA的表达,早获批的ASO药物的是Ionis的fomivirsen,用于治疗巨细胞病毒性视网膜炎,特别适用于合并感染人类免疫缺陷病毒(HIV)的患者,于1998年获批上市。然而,该药在2001年被FDA撤回,原因是HIV患者的抗逆转录病毒疗法显著减少了对该药的需求。
目前,已被美国FDA批准的ASO药物还有mipomersen、inotersen、nusinersen、eteplirsen和golodirsen。除了这些已获批上市的药物外,目前还有多种ASO药物处于临床研究阶段,包括针对亨廷顿病中亨廷顿蛋白的突变形式的IONIS-HTTRx,针对SOD1蛋白的tofersen等。
siRNA
2001年,siRNA(小干扰RNA)技术曾被《科学》杂志评为当年十大技术进步之一。但直到2018年,FDA才批准首款siRNA药物Patisiran上市,用于治疗神经退行性疾病hATTR变性。
siRNA使用内源性RNA干扰途径来调节其靶RNA的表达。迄今为止,已有四种基于siRNA的药物被美国FDA批准,包括patisiran、givosiran、lumasiran和Inclisiran。
适配体
适配体是设计用于结合特定蛋白质以调节其功能的核酸构建体。迄今为止,只有一种适配体药物获得美国FDA的批准。Pegaptanib是一种28个核苷酸的构建体,被批准用于治疗湿型(新生血管性)年龄相关性黄斑变性(AMD)。
mRNA
mRNA疗法利用即使是外源性mRNA也可翻译成功能性蛋白质这一事实来发挥其治疗效果。mRNA疗法可根据其目的分为两大类:一类是将外源mRNA引入细胞以替代或补充内源蛋白质;另一类是将mRNA转录物设计用作针对传染病或癌症抗原的疫苗。
其中mRNA疫苗的效用已在mRNA新冠疫苗中得到了充分的证明。2021年,BioNTech和Moderna也凭借这一疫苗一跃进入超级大药企行列。
目前,受到mRNA新冠疫苗商业化巨大成功的激励,国内已有众多企业纷纷投入mRNA赛道,艾博生物、斯微生物、威斯津生物、康希诺、石药集团、蓝鹊生物等企业均在加速产品研发。其中,艾博生物与军事科学院军事医学研究院、沃森生物共同研制的新冠mRNA疫苗ARCoVaX是国内首个获批开展临床试验的mRNA疫苗。据沃森生物今年3月发布的调研活动信息显示,ARCoVaX国内三期临床的现场工作基本结束,正在进行数据整理和持续血清检测。艾博生物也因此在2021年顺利完成3轮融资,累计融资超11亿美元。
除了较热的mRNA赛道,国内药企在其他核酸药物赛道也有布局,例如去年年底在港交所上市的圣诺医药主要聚焦于RNAi疗法,目前已搭建了10余款产品在研的丰富产品管线。
RNA疗法还需要哪些突破?
近年来,随着新型RNA药物的发现、递送介质的优化、对RNA药物作用机制的进一步理解、以及对于疾病机制的更深入解析,RNA疗法已在稳定性提高、脱靶性降低、以及靶向药物活性增强等方面取得突破性进展。
然而,RNA药物的递送系统仍然是这类疗法面临的大挑战之一。
由于RNA本质上是不稳定的,需要运输工具来保护药物免受RNA酶降解,因而就需要能成功将RNA药物靶向递送至治疗部位的新型递送载体。
目前,脂质纳米颗粒(LNP)是常用的RNA递送技术。2018年获得美国FDA批准的全球首个siRNA药物采用的就是LNP载体。目前国际上mRNA行业三大巨头Moderna、CureVac和BioNTech所开发的新冠疫苗,均采用了LNP递送技术。但LNP制造工艺复杂,成品剂型的稳定性有限(只有6个月),且需要冷链储存及运输。
另一种常用的RNA递送系统是GalNAc。该技术利用了人体蛋白的靶向功能,由于该蛋白在肝细胞上大量表达,所以RNA可以自然地集中在肝脏中,是针对肝脏靶向递送的有效方法。基于这项技术的RNA疗法相对于LNP载体较为简单,且成品剂型可以冻干以提高稳定性,无需冷链储存及运输。2019年获批上市的Givosiran是世界上第一个获得FDA批准的以GalNAc作为载体的siRNA药物。但GalNAcRNAi递送系统只能将siRNA送入肝细胞,大幅降低了GalNAcRNAi的适用性。
除了上述两种递送技术,还有企业开发多肽纳米导入系统(PNP)、脂质纳米晶体(LNC)递送、外泌体递送、噬菌体和细菌微细胞递送等递送技术,但能否顺利应用于临床还是未知数。因此,RNA药物的递送研究仍然非常漫长。
过去几十年,RNA疗法的研发时好时坏,在曲折中发展。总体而言,RNA疗法仍处于初始阶段,随着技术的进步,RNA疗法或将为更多疾病提供有效的治疗方案。
参考资料
1.RNA therapy: rich history, various applications and unlimited future prospects.

