2000 年gemtuzumab ozogamicin (Mylotarg) 是美国食品和药物管理局(FDA)批准的第一个 ADC 药物。目前,FDA 已经批准上市了 11 个 ADC药物,还有上百个 ADC 药物正处于临床研究阶段。

ADC对于药物靶点的选择,除了首先要在肿瘤过度表达外,这些抗原的另一个重要因素是内吞的效率,这是药物释放活性所必需的。事实上,ADC的疗效取决于靶向介导的内化在肿瘤细胞内传递有效载荷的效率。
ADC内化的途径和效率,也与ADC药物的疗效和设计息息相关。因为它是连接子选择可切割、不可切割或pH/还原敏感型的重要因素,以及有效载荷(或其活性代谢物)是否能够在细胞膜上扩散以提供“旁观者效应”,还有是否提高了肿瘤杀伤率或有助于剂量限制毒性。因此有必要深入了解ADC的内吞作用和机制,因为它是ADC在体内发挥药效中极其重要的第一步。
一般来说,正常的内吞作用可分为三个阶段:(1)芽的形成;(2)膜的弯曲和囊泡的成熟;(3)膜的断裂并释放到细胞质中。多种内吞途径有重叠的方面,因此内吞的一般过程是高度灵活和复杂的。
网格蛋白介导的内吞作用
网格蛋白介导的内吞作用(CME)在概念上是一个简单的过程,包括几个连续和部分重叠的步骤。
CME可由质膜上的某些受体结构性启动,或者需要配体和/或抗体结合后启动。当细胞质中的内吞衣壳蛋白开始聚集在质膜的内小叶上时,CME就开始了。接下来,衣壳蛋白通过从细胞质中招募并与额外的蛋白质适配器相互作用而继续组装和生长。关键的衔接蛋白使膜弯曲,从而将内化受体/配体集中到一个“网格蛋白包被坑”(CCP)中。由于CCP内陷增大,CCP颈缩窄时,通过一个断裂过程与质膜分离。肌动蛋白聚合将CCP向内拉入细胞质,直到断裂完成,CCP释放并成为一个网格蛋白包被的囊泡(CCV)。最后,CCV外壳被分解,CCV与内涵体融合以运输到特定的亚细胞位置,或者可以被回收回细胞表面。
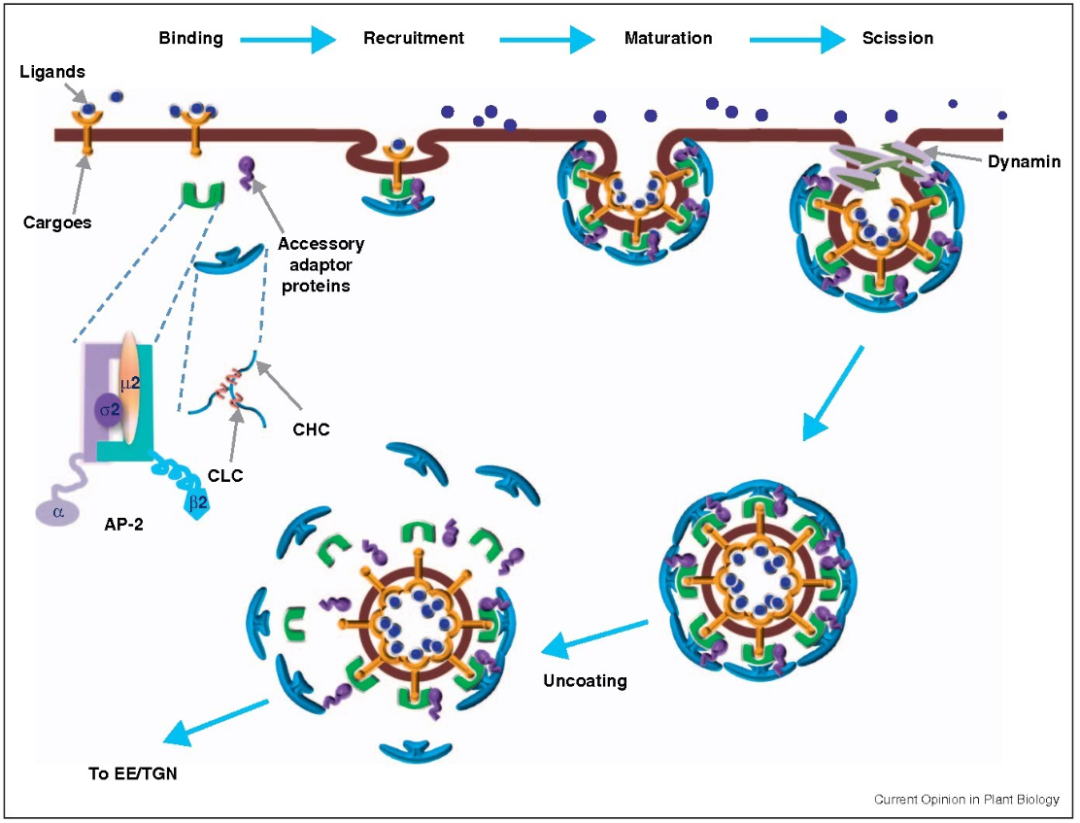
网格蛋白是CME的关键成分,由重链和轻链组成。三个网格蛋白重链和轻链形成一个三聚体,它与其他三聚体相互作用,并在新兴的CCP周围形成一个多边形晶格。
衔接蛋白2(AP-2)是一种异源四聚体复合物,它介导CCP颈部的收缩。Dynamin是一种GTP酶,在成熟囊泡的颈部形成螺旋状聚合物。GTP水解后,dynamin诱导囊泡从质膜分裂。
网格蛋白非依赖性内吞作用
不依赖于网格蛋白的内吞作用包括小窝介导的内吞作用、小窝蛋白非依赖性载体蛋白/GPI-富集的早期内区室(CLIC/GEEC)和巨胞饮作用。
小窝介导的内吞作用
小窝是质膜的小瓶状内陷,其特征是高水平的胆固醇和鞘糖脂,通过不依赖于网格蛋白的途径介导内吞作用,并且存在于大多数细胞类型中。小窝的主要支架蛋白是小窝蛋白,它是形成寡聚体的20–24 kDa完整膜蛋白。小窝蛋白共享共同的支架结构域,这些支架结构域介导与自身和其他包含小窝蛋白结合结构域蛋白质的相互作用。
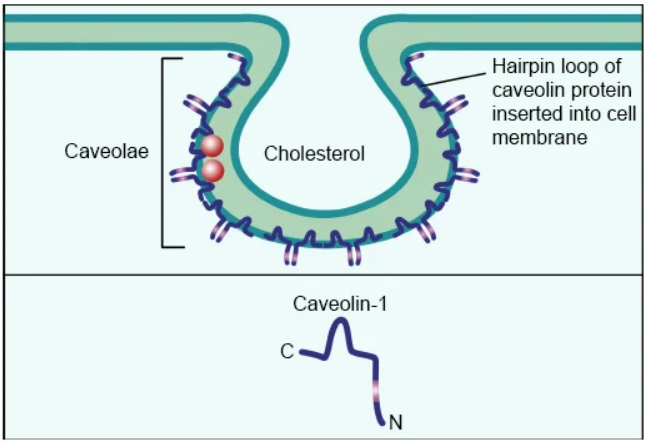
虽然小窝具有类似CCPs的内陷形态,但它们是不同的。简单地说,CCP的密度是恒定的,而小窝的密度会因细胞类型的不同而变化很大。CCPs随着萌发的内体成熟而增大,相比之下,小窝囊泡保持不变的大小。一旦进入细胞内,小窝就形成了高阶结构,而不是由CCPs形成的简单的球形内体。
小窝蛋白介导的内吞作用的另一个独特方面是,只有约1%的小窝是从质膜上萌发的。在一小部分内化的小窝中,它似乎遵循一条与Rab5(早期内胚体的标志物)共定位的循环途径。这可能对以利用小窝蛋白介导内吞作用的受体为靶点的ADC带来挑战。
CLIC/GEEC内吞作用
CLIC/GEEC是一种内吞室,主要发生在配体激活的细胞中,这可能由生长因子、抗体的受体交联或细菌毒素和病毒引起。此外,细胞膜必须处于高流动性状态,因为CLIC/GEEC在低于生理温度或膜处于更高张力的情况下不起作用。

CLIC在迁移细胞的前缘增加。识别CLIC/GEEC途径的其他相关参数包括动力非依赖性质膜断裂、对胆固醇消耗的敏感性、Rab5/与早期内体融合的获得、胎盘碱性磷酸酶(PLAP)和与FAK相关的GTPase调节因子(GRAF1)。
巨胞饮作用
巨胞饮作用是一种更大规模的内吞作用形式,通常涉及质膜高度皱折的区域/突起,这些区域/突起随后相互融合或与质膜融合。膜皱褶是巨胞饮作用的形态学特征。

巨胞饮作用依赖于肌动蛋白聚合、Rac1蛋白和p21活化激酶1(PAK1)。PAK1是一个关键的调节因子,因为它与Rac1相互作用,Rac1激活磷脂酰肌醇-3-激酶(PI3K)、Ras、Src和Hsp90,以促进巨胞饮作用。巨胞饮作用也是胆固醇依赖性的,这是招募Rac1所必需的。这些成分最终导致比CME和小窝蛋白更大吸收面积的内吞作用。

CD33
CD33是一种67kda跨膜糖蛋白受体,通常在正常髓系细胞上表达,由于其在AML细胞上优先过表达,是GO的靶点。CD33的胞内免疫受体酪氨酸基抑制基序(ITIM)调节CD33的内吞作用,可通过CME激活内吞作用。关于内吞效率,AML细胞中CD33的表达水平与其内吞率之间没有相关性。CD33是一种缓慢内化的抗原,此外,CD33交联并不能改善内吞作用。对GO无响应的AML患者可能与CD33受体内吞的功能低下有关。
CD30
CD30是一种120kda跨膜糖蛋白,属于肿瘤坏死因子受体(TNFR)超家族。其细胞外部分由六个扩展构象的富含半胱氨酸的结构域(CRD)组成。CD30在活化的T细胞和B细胞以及各种淋巴肿瘤(包括霍奇金淋巴瘤和ALCL)上表达。
CD30不具有内吞作用,相反,它因蛋白水解裂解而脱落,CD30的脱落由基质金属蛋白酶(MMPs)介导。脱落是CD30生物学的一个特征,高浓度的循环可溶性CD30可以作为监测肿瘤进展的血清标志物。对于ADC的疗效,升高的CD30循环水平似乎会隔离注射的ADC,从而减少能够定位于CD30阳性肿瘤部位的ADC的数量。因此,缺乏内吞作用的结果表明CD30不是理想的ADC靶点。
CD22
CD22是一种140 kDa的跨膜糖蛋白,与CD33一样,它也是Siglec家族的成员,并与该家族共享多种结构特征。关键的区别在于CD22比CD33大得多,因为它有多个Ig结构域和ITIM/ITIM样基序。CD22的表达仅限于B细胞,CD22在各种B细胞恶性肿瘤(包括ALL)的大多数母细胞中表达水平升高。
CD22通过CME进行内吞作用。类天然配体通过CD22的结构性快速内吞在细胞内积聚。这些配体在溶酶体中被分类降解,而CD22则循环回到细胞表面。此外,CD22配体诱导的内吞激活细胞内池,补充或增加细胞表面CD22的表达水平。因此,CD22对ADC具有良好的内吞特性。
CD79b
CD79b仅在未成熟和成熟的B细胞中表达,在恶性肿瘤≥80%的B细胞中过表达。CD79a和CD79b是两种非共价结合的跨膜蛋白,介导信号传导和内吞作用。对于后者,CD79a-CD79b异二聚体是控制BCR内吞的支架。BCR内吞作用主要由CME完成,并由AP-2介导。有趣的是,CD79a直接与AP-2的μ亚单位相互作用,进而激活CD79b并导致整个BCR复合物的内吞。
此外,对于ADC来说,CD79a可以作为单体内化,但CD79b却不能。如果CD79b的近端膜酪氨酸(Y195)发生突变,AP-2与CD79a的结合就会被阻断,内吞也被阻断。在18%的活化B细胞样DLBCL标本中,Y195发生突变。总之,有证据表明CD79b其内吞活性依赖于整个BCR复合体的内化,而不是作为单体的内化。
TROP-2
Trop2是一种46kDa的单体糖蛋白,具有选择性过度表达、结构性内吞作用和导向溶酶体等特性,使其成为ADC的一个非常有吸引力的靶点。Trop2的内化机制与CME有关。
观察到的Trop2强大的内吞作用,一种潜在的解释可能是由于显著的Trop2聚集。研究Trop2的构象动力学,发现Trop2通过位于跨膜结构域的氨基酸“VVVVV”组成的相互作用片段形成天然的同型二聚体。Trop2的二聚作用可以通过其他细胞表面蛋白质进一步将Trop2单体招募到更接近的位置。因此,Trop2簇很可能由多个二聚体通过脂筏和其他膜结合蛋白连接而成。
Trop2与多种配体结合,如claudin-1、claudin-7、cyclin D1和IGF1,然而,这些配体都没有证明在与Trop2结合或相互作用时被内化。因此,与正常细胞相比,Trop2在肿瘤细胞中发生的内吞作用更为强烈,这些都表明Trop2是ADC的一个很好的靶点。
BCMA
BCMA或CD269,也称为TNFR超家族成员17,转导诱导B细胞存活和增殖的信号。BCMA的分子量仅为20.2 kDa,其配体结合的胞外区域具有“臂椅”构象,由六个CRD组成。除了多发性骨髓瘤外,BCMA还表达于许多血液系统恶性肿瘤,如霍奇金淋巴瘤和非霍奇金淋巴瘤。
然而,关于BCMA所利用的精确内吞途径的知之甚少。与内吞作用有关,唾液酸化是一种调节功能,它可能诱导BCMA利用CME发生内吞作用。
HER2
HER2是一种185kda跨膜糖蛋白,属于EGFR家族。HER2/neu基因的扩增是已知的人类恶性肿瘤和转移的驱动因素。由于HER2在癌症中的作用,几十年来一直被作为治疗靶点。HER2也一直是ADCs的靶点,T-DM1和T-DXT都被批准用于HER2阳性转移性乳腺癌患者。
HER2的内吞存在多种机制,首先是CME,共免疫沉淀清楚的显示HER2直接与AP-2结合,此外,dynasore能完全阻断SKBR3细胞的HER2内吞作用;其次小窝蛋白结合基序φxφxxxxφ(φ代表芳香族氨基酸Trp、Phe或Tyr)通常存在于小窝蛋白相关蛋白上,有趣的是,序列WSYGVTIW已在HER2的细胞内激酶结构域中被鉴定出;另外,有研究证明HER2可以利用CLIC/GEEC的内吞途径。
这些不同的发现揭示了HER2内吞的重要特征。首先,HER2的内吞作用是混杂的,其次,小窝介导的内吞途径似乎更常被利用。
Nectin-4
Nectin-4是一种66 kDa 的I型跨膜蛋白,其主要作用是促进细胞间的接触。Nectin-4作为ADC靶点很有吸引力,因为研究表明,它在几种肿瘤类型中过表达,但在正常成人组织中几乎不存在。
目前,没有发现天然配体或mAb/ADC与nectin-4的复合物内吞的信息,但是可以借鉴nectin-4结合病原体内吞的研究。Nectin-4也是麻疹病毒的受体,研究表明,麻疹病毒通过巨胞饮作用进入MCF7、HTB-20乳腺癌和DLD-1结直肠癌细胞。病毒进入需要PAK1,相反,dynamin抑制剂Dynasore对病毒进入没有影响。此外,表达显性负性小窝蛋白的细胞并不能消除病毒的内吞作用。
基于这些间接研究,nectin-4表现出病毒受体所需的强大的内吞活性。
分析靶受体和ADC的内吞作用内吞可以极大地促进临床前研究、临床转化和患者治疗效果。很明显,内吞作用的效率和ADC靶受体的优先过表达状态以及其它相关参数(如PK)一样重要。尽管目前已有11种已批准的ADC,但是由于ADC的技术进步,该领域正在经历一次爆发。
药物剂量-暴露-效应关系的确定是ADC成功的关键部分,因此,内吞作用是这种关系的关键部分,对于优化给药方案以最大限度地提高治疗指数非常重要。然而尽管目前ADC领域如火如荼,但是我们对靶受体的内吞作用仍知之甚少。另外,许多内吞作用的核心成分和关键的效应器非常重要,然而这些蛋白可能在癌症中普遍发生突变,这也会影响ADC内吞作用和疗效。相信随着该领域的发展,经过无数次积累的经验,ADC终会迎来真正的春天。

