FDA手握“生杀大权”,不仅影响着大药企,还决定着众多Biotech的生死,也牵动着国内药企们的心。据不完全统计,今年上半年已经有10多款药物被拒,看看原因何在?或许能为业内理解FDA的审评标准提供帮助。
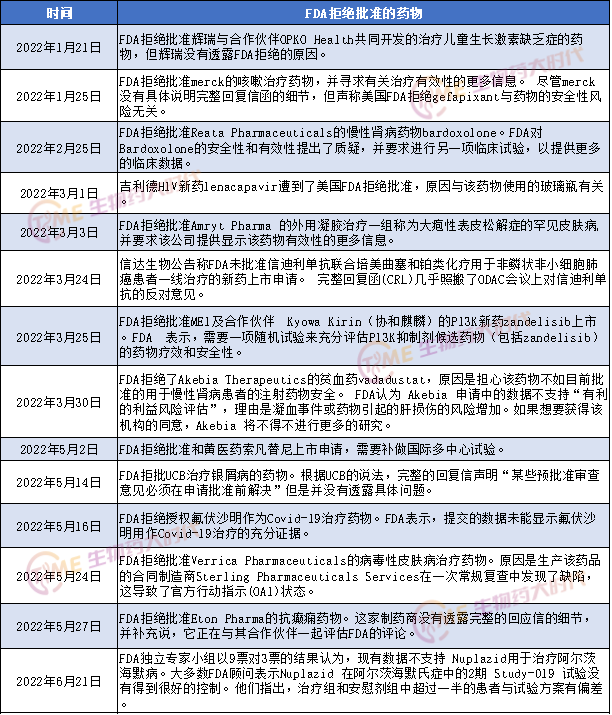
今年上半年被FDA拒绝批准的药物主要集中在3月和5月份,各有5款。1月份,有两款药物被FDA拒批。
1月21日,辉瑞表示,FDA拒绝批准其与合作伙伴OPKO Health Inc (OPK.O) 共同开发的治疗儿童生长激素缺乏症的药物,但辉瑞没有透露FDA拒绝的原因。Somatrogon是一种实验性的、每周一次的长效重组人生长激素,用于治疗儿科患者的生长激素缺乏症 (GHD)。2014年,辉瑞和OPKO就用于治疗GHD的somatrogon的开发和商业化达成了一项全球协议。根据协议,OPKO负责开展临床项目,辉瑞负责GHD产品的注册和商业化。
1月25日,FDA拒绝批准merck的咳嗽治疗药物,并寻求有关治疗有效性的更多信息。尽管merck没有具体说明完整回复信函的细节,但声称美国FDA拒绝gefapixant与药物的安全性风险无关。merck研究公司高级副总裁兼全球临床开发负责人、首席医疗官Roy Baynes博士表示,merck将仍然致力于为难治性或不明原因慢性咳嗽患者推进gefapixant的研发工作,并将与美国FDA合作解决该机构的反馈意见,“merck认为,帮助患者控制慢性咳嗽的临床需求目前尚未得到满足,因为在美国市场没有专门针对这种情况的治疗方案。”
2月份,FDA拒绝批准Reata Pharmaceuticals的慢性肾病药物bardoxolone。FDA对Bardoxolone的安全性和有效性提出了质疑,并要求进行另一项临床试验,以提供更多的临床数据。
3月份,有5款药物被FDA拒绝批准。其中包括信达生物的PD-1。FDA在回覆函中建议信迪例单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。
其次还有:吉利德HIV新药lenacapavir遭到了美国FDA拒绝批准,原因与该药物使用的玻璃瓶有关;FDA拒绝批准Amryt Pharma 的外用凝胶治疗一组称为大疱性表皮松解症的罕见皮肤病,并要求该公司提供显示该药物有效性的更多信息;FDA拒绝批准MEI及合作伙伴 Kyowa Kirin(协和麒麟)的PI3K新药zandelisib上市,FDA 表示,需要一项随机试验来充分评估PI3K抑制剂候选药物(包括zandelisib)的药物疗效和安全性;FDA拒绝了Akebia Therapeutics的贫血药vadadustat,原因是担心该药物不如目前批准的用于慢性肾病患者的注射药物安全。FDA认为 Akebia 申请中的数据不支持“有利的利益风险评估”,理由是凝血事件或药物引起的肝损伤的风险增加。如果想要获得该机构的同意,Akebia 将不得不进行更多的研究。
5月份有5款药物遭到FDA拒绝批准。其中包括和黄医药索凡替尼、UCB治疗银屑病的药物、用氟伏沙明作为Covid-19治疗药物、Verrica Pharmaceuticals的病毒性皮肤病治疗药物以及Eton Pharma的抗癫痫药物。
6月份,FDA独立专家小组以9票对3票的结果认为,现有数据不支持Acadia重磅痴呆症药物Nuplazid用于治疗阿尔茨海默病。Nuplazid是一种选择性5-羟色胺反向激动剂和拮抗剂,于2016年获得批准,成为第一种被批准用于治疗与帕金森病精神病相关的幻觉和妄想的药物。大多数FDA顾问表示Nuplazid 在阿尔茨海默氏症中的2期 Study-019 试验没有得到很好的控制。他们指出,治疗组和安慰剂组中超过一半的患者与试验方案有偏差。
7月4日,NRx Pharmaceuticals公司宣布,美国FDA拒绝授予阿肽地尔(aviptadil、Zyesami)治疗有呼吸衰竭直接死亡风险危重新冠肺炎患者的紧急使用授权(EUA)。

