开辟肿瘤治疗新篇章,ADC肿瘤免疫时代来临。
抗体偶联药物(Antibody-drugconjugates,ADC)由单克隆抗体、连接子和载药三部分构成,ADC通过单克隆抗体特异性地结合肿瘤细胞表面高表达的靶抗原,形成ADC-抗原复合物,然后通过网格蛋白(clathrin)介导的内吞作用进入细胞,使载药进入肿瘤细胞发生药力从而杀死肿瘤细胞。
ADC药物兼具抗体的高特异性和细胞毒素的高抗肿瘤活性,同时因其定向释放的特性,安全性更加可控,是目前肿瘤治疗领域的热点研究方向之一。
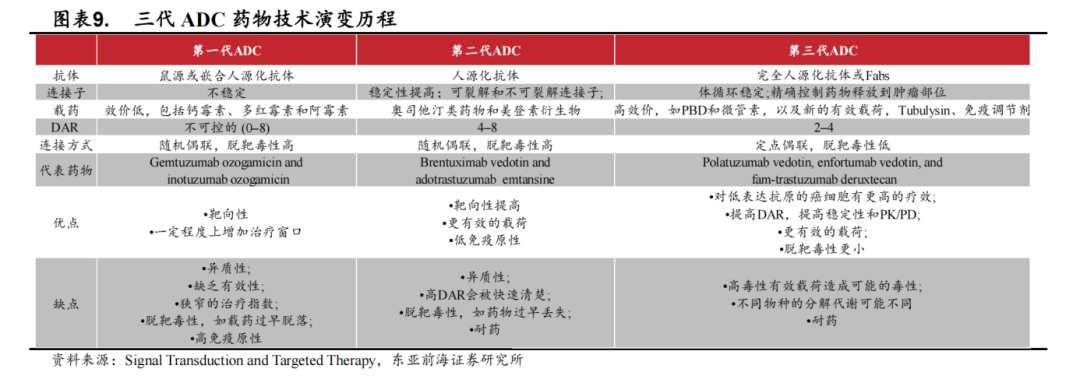
三代技术变革
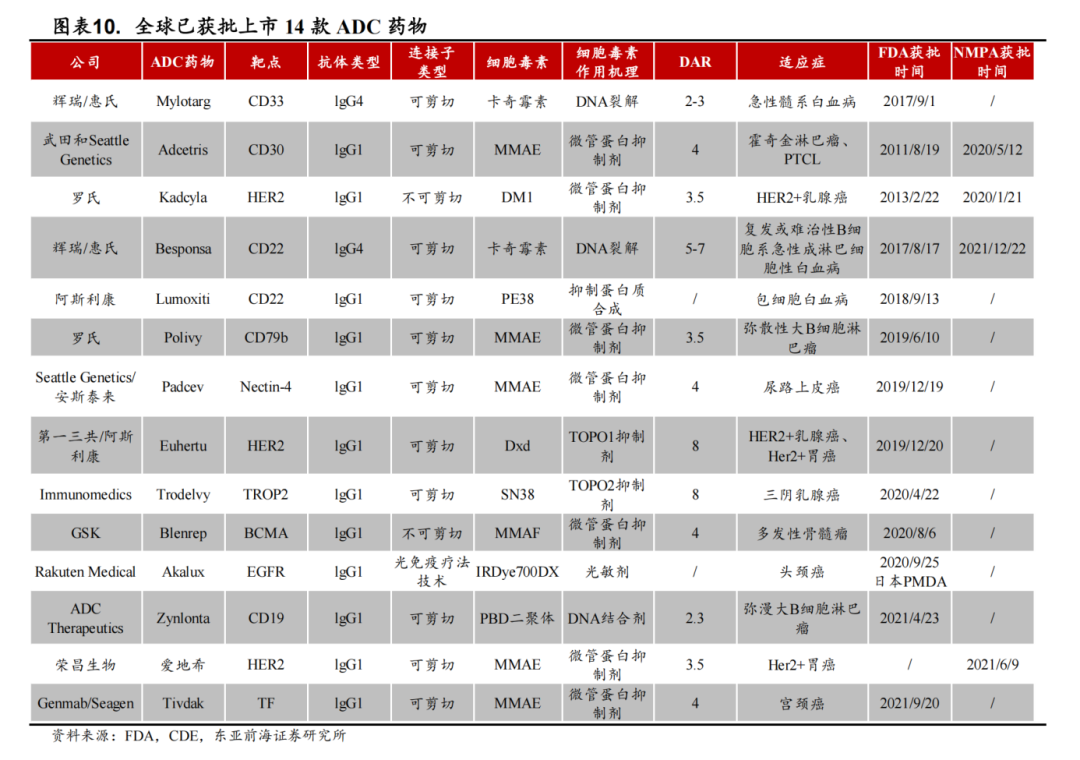
14款ADC获批上市
从1910年,免疫学之父PaulEhrilich提出“魔法子弹”的概念,到112年后的今天,ADC药物的发展已有了质的飞跃。
从技术上来看,ADC药物至今共经历了三代技术变革,在抗体、载药、连接子等方面均有突破。第一代的ADC药物以Mylotarg为代表,抗体多采用鼠源或嵌合人源化抗体,连接子不稳定,载药的毒性较低且是随机偶联因而有效性不高,毒副作用较大。
第二代的ADC药物以Adcetris和Kadcyla为代表,采用人源化抗体、毒性更高的载药、抗体的靶向性也更好,但随机偶联造成的脱靶毒性仍不可忽视。
第三代的ADC药物以DS-8201为代表,完全人源化的抗体、高毒性载药以及定点偶联技术的使用使得疗效更好,但高毒性载药所带来的可能毒副作用仍存在。
图片来源:东亚前海证券研究所研究报告
从研发上来看,截止目前,全球已有14款ADC药物获批上市,且2021年全球销售额突破50亿美元。
根据药智数据显示,全球ADC临床开发项目共471个,靶点主要集中在HER2(38.4%)、EGFR(11.9%)、TROP-2(9.9%)、Claudin18.2(9.9%)少数几个热门靶点上。
从布局的适应症来看,95.17%的管线布局的适应症均是肿瘤,其次是自身免疫性疾病(1.75%)、细菌感染(0.66%)、湿性年龄相关性黄斑变性(0.66%)等。
从研发进度来看,目前绝大多数的研发项目均处于早期阶段。其中临床前占比46.78%,临床I期占比29.93%,临床I/II期占比7%,临床II期占比7.54%。
图片来源:东亚前海证券研究所研究报告
从资本市场来看,相比于传统疗法,ADC拥有无可比拟的优势,激发了全球的开发热情。为了进入该领域,ADC相关的BD交易无论是数量还是金额都直线上升。
2020年吉利德以210亿美元的高价收购了ADC公司Immunomedics,创下当年最高交易纪录。盘点2021年的BD交易,我们可以看到第一三共成为最大的赢家,它的两款产品DS-8201和DS-1062均达成了金额超60亿美元的交易。
另外,国内本土创新药企荣昌生物将维迪西妥单抗的海外权益以26亿美元的高价出售给Seagen,进一步证明了中国企业的研发实力。在2022年2月,强生和礼来分别与ADC公司Mersana和ImmunoGen达成了金额超10亿美元的合作,巨头的入局让该赛道更加火热。
全球主要代表性ADC药物
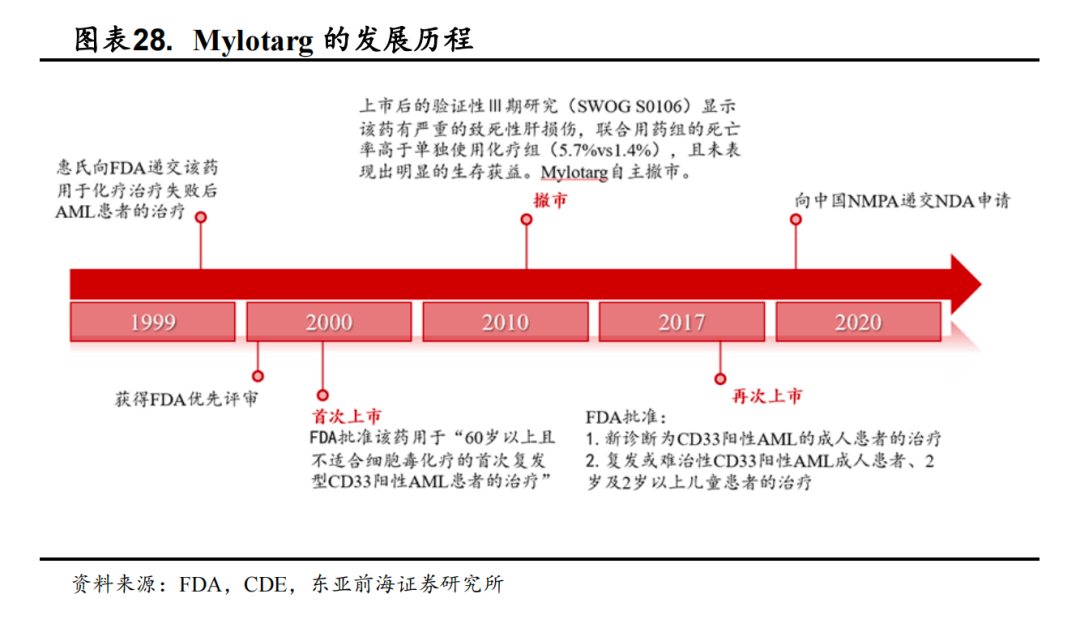
Mylotarg:全球首个成功上市的ADC
Mylotarg(吉妥珠单抗)原研公司为辉瑞,由靶向CD33的单抗与抗肿瘤抗生素卡奇霉素偶联而成,该药是全球第一个上市的ADC药物,也是获得FDA加速批准的所有新药中第一个退市的药物,同时又是第一个退市后再次上市的ADC药物。目前已获FDA批准的适应症包括:1)初诊CD33阳性的成人和大于1个月的儿童急性骨髓性白血病(AML);2)复发或难治性的CD33阳性成人和大于2岁的儿童急性骨髓性白血病(AML)。
图片来源:东亚前海证券研究所研究报告
值得一提的是,Mylotarg的退市风波。2000年,FDA批准了Mylotarg上市用于“60岁以上且不适合细胞毒化疗的首次复发型CD33阳性AML患者的治疗”,但上市后的验证性Ⅲ期研究(SWOGS0106)发现该药有严重的致死性肝损伤,联合用药组的死亡率高于单独使用化疗组(5.7%vs1.4%),而且未表现出明显的生存获益。当年6月,辉瑞主动将Mylotarg撤市,并对“给药方案”进行了优化:一方面,通过降低单次给药剂量(由9mg/㎡降低至3mg/㎡)从而降低毒副作用,此外还在给药方案中引入“诱导周期”和“巩固周期”以确保疗效。得益于给药方案的调整,Mylotarg的临床疗效得到了提高,并为再次上市打下基础。
Mylotarg的波折遭遇也凸显了“给药方案”的重要性,更是在撤市风波后重振雄风,一鼓作气更是将AML适应症由原来的后线用药推到了一线用药,给后来者积累了宝贵的经验。
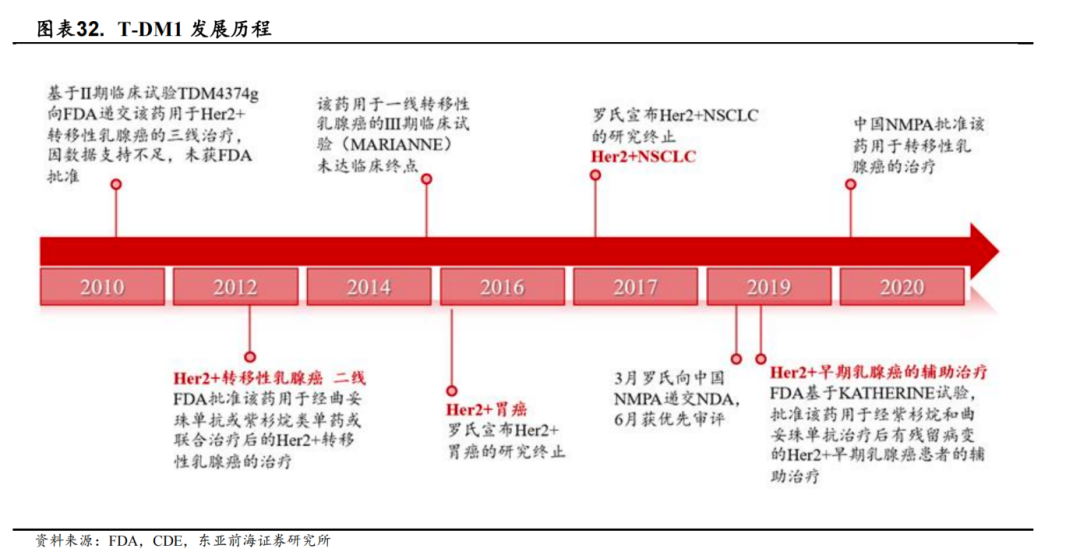
Kadcyla:全球首个获批用于实体瘤的ADC
Kadcyla(T-DM1,恩美曲妥珠单抗)是罗氏研发的一款HER2ADC药物,由靶向HER2的曲妥珠单抗与抑制微管聚集的化疗药物美坦新(DM1)通过不可裂解的硫醚连接子MCC连接而成,不存在“旁杀者效应”。T-DM1是全球第一个获批用于实体瘤(乳腺癌)的ADC,已获FDA批准上市的适应症包括“HER2阳性早期乳腺癌的辅助治疗”,以及“HER2阳性转移性乳腺癌的二线治疗”,但它在胃癌和NSCLC上并未达到像乳腺癌中的预期效果,T-DM1于2020年1月成为中国大陆第一个获批上市的ADC药物。
图片来源:东亚前海证券研究所研究报告
Adcetris:血液瘤领域商业化最成功的ADC
Adcetris(维布妥昔单抗)由靶向CD30的人鼠嵌合单抗Brentuximab、可裂解的瓜氨酸-缬氨酸二肽连接子和微管抑制剂MMAE偶联而成,DAR为4,分子量为153kDa。作为血液瘤领域商业化最为成功的ADC药物,Adcetris的2021年全球销售额13.06亿美元,在全球ADC药物领域排名第二。目前,该药在全球已获批六项适应症,主要集中在系统性间变性大细胞淋巴瘤(sALCL)、外周T细胞淋巴瘤(PTCL)、经典霍奇金淋巴瘤(cHL)三个癌种,围绕这三个癌种不断深耕,成功从后线推移到一线,树立了CD30淋巴瘤一线治疗的标杆。

图片来源:东亚前海证券研究所研究报告
DS-8201:全面围剿二代ADC药物
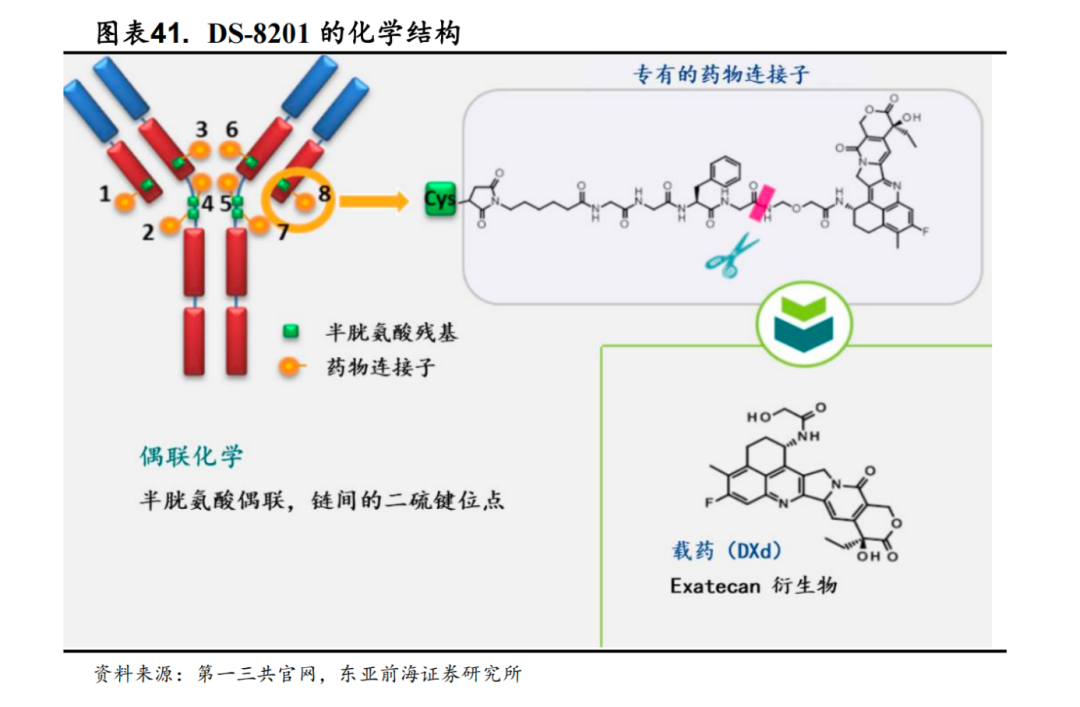
DS-8201是一款靶向HER2靶点的第三代ADC药物,由连接子、毒素、弹头三部分组成。
相比于第二代ADC,DS-8201将不可裂解连接子升级为可裂解连接子,采用定点偶联的偶联方式,药物抗体比可以达到8。升级后第三代ADC展现出了强大的肿瘤杀伤力。
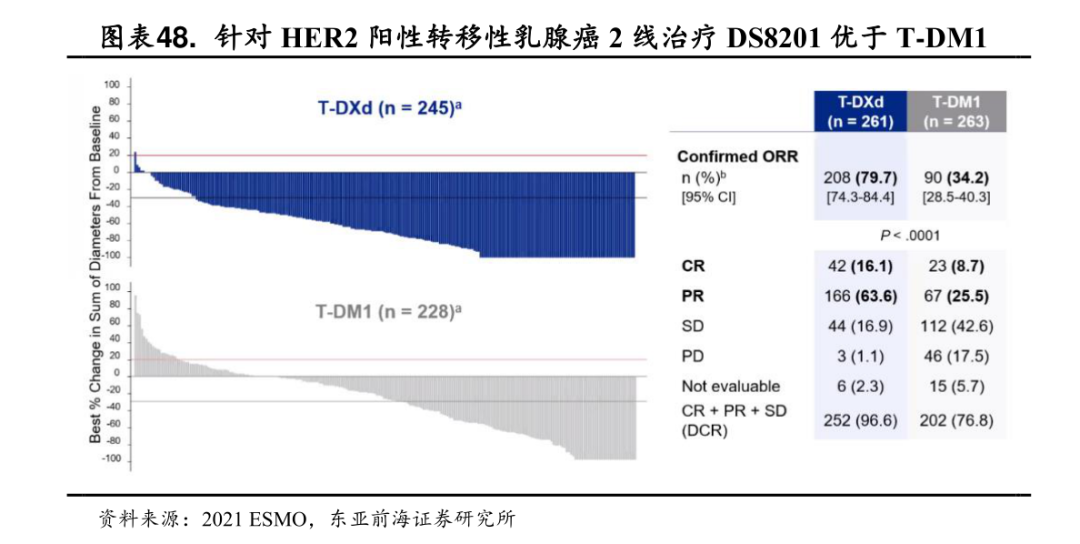
自上市以来,DS-8201创造了许多辉煌的战绩。2021年11月,DS-8201在头对头临床试验中,击败了二代HER2ADC药物T-DM1,并在不久后成功取代T-DM1跻身乳腺癌的二线疗法。2022年6月,DS-8201又拿下了一座针对HER2低表达的“圣杯”。
阿斯利康官网发布消息数据:“与化疗相比,在患有HR阳性和HR阴性的HER2低转移性乳腺癌患者中,enhertum将疾病进展或死亡的风险降低了50%”。结果显示,在HR阳性患者中,与化疗相比enhertum的死亡风险降低了49%,它的中位生存期长达为23.9个月,化疗为17.5个月。结果还显示,enhertum在HR阳性或HR阴性的HER2低转移性乳腺癌患者与化疗相比,它的死亡风险降低了36%,整体的中位无进展生存期为5.1个月VS9.9个月,中位总生存期为16.8个月VS23.4个月,简直是不可思议!
不少业界大咖直言,DS-8201开创了一个治疗乳腺癌的新时代。不过悲喜总是相伴而来。DS-8201强悍的表现对于后来的药企来说,则成为了跨不过去的天堑。可以说,有DS-8201在前,在HER2靶点上后来者很难再找到一条前进的路。
图片来源:东亚前海证券研究所研究报告
图片来源:东亚前海证券研究所研究报告
当前,DS-8201一方面在探索与抗PD-1抗体等免疫疗法联用,另一方面还在不断扩大适应证。目前在结直肠癌、三阴性乳腺癌、膀胱癌等癌种中进行临床试验,强悍的临床疗效加上不断扩展的适应症使得DS-8201一时间风头无两。
NatureReviewsDrugDiscovery预测该药将在2026年全球销售额达到62亿美元,占全球最早上市的10款ADC药物近4成份额。
在中国市场,2020年12月DS-8201获得CDE授予的突破性疗法资格,单药用于既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部(GEJ)腺癌成人患者的治疗。今年3月21日,DS-8201在国内的上市申请获得NMPA受理。
后DS-8201时代
ADC药物开发该何去何从?
ADC作为国内继以抗PD-1单抗为代表的第一波创新药之后技术成熟度最高的药物发展方向,激发了各大药企的热情,成为兵家必争之地。从以百奥泰BAT8001为代表的第一代简单粗暴模仿罗氏的T-DM1,到第二代以荣昌生物RC48为代表的对抗体、linker、payload进行有限改良,再到现在大力发展定点偶联技术为代表的第三代ADC,总体来说保持了持续向好发展的态势。
DS-8201的亮眼数据给全球各大ADC开发企业都带来了较大压力,但DS-8201并非完美无缺。首先从安全性方面来看,在多个适应症中发现DS-8201会引发间质性肺炎,具有致死性,被FDA列入黑框警告;其次,DS-8201的价格不友好,在香港购买该药品7-8万/月(深蓝观披露),这让绝大多数国内患者望而却步。
从国内第一波以抗PD-1单抗研发为代表的创新药浪潮的经验教训来看:时间上,当时K药和O药都已经获批上市1年多,国内最早的抗PD-1单抗产品才进入临床试验申请阶段。但最终国产的抗PD-1单抗相继开发成功,对于广大肿瘤患者来说拥有了相比于进口药廉价的新的治疗选择。另外,国产抗PD-1单抗价格虽然比进口的K药和O药便宜,但销售额却占据绝对优势,“薄利多销”策略让国内创新药企在第一波浪潮中站稳了脚跟。
其次,创新者生,守旧者亡。面对DS-8201的压力,我们看到已经出现了一些苗头有望与之竞争。荣昌生物之所以能成为第一个国产ADC获批的药企,很大程度上归功于适应症的选择。临床急需,竞争格局良好的适应症,不仅在开展临床试验时容易募集患者,节省研发成本,而且会加快研发进度,成功上市后,商业化前景也是可期。像RC48针对的胃癌、尿路上皮癌的后线治疗,抑或是HER2低表达的乳腺癌都是如此。在适应症的选择上避开DS-8201的优势项目,不仅降低将来与DS-8201做头对头试验的风险,而且很可能通过单臂或者与化疗做对照就可以申报上市,跑赢竞争对手。
对于HER2阳性乳腺癌的后线治疗新码生物ARX788的I期剂量爬坡研究的结果患者的临床获益率不输于DS-8201,但安全性却更好;此外,针对HER2阳性实体瘤的泛癌种I期剂量递增试验中对于既往接受过T-DM1和DS-8201治疗失败的患者,ARX788仍能带来临床缓解。同样科伦药业的A166针对HER2阳性乳腺癌的后线治疗I期剂量扩展研究中表现出对患者的临床获益率不输于DS-8201,而且整体不良反应可控。由此可观,DS-8201的技术路线并非是ADC开发的唯一优化路径,在ADC这个领域是可以走出一条差异化发展之路的。
华东医药引进的ImmunoGen靶向FRα的ADC新药mirvetuximabusoravtansinem,当初作为单药治疗铂耐药卵巢癌的疗效和安全性的临床III期研究FORWARDI,初次分析该临床结果发现不限FRα表达状态的全部入组人群中主要临床终点PFS与化疗组并无显著性差异,随后却在FRα高表达的亚组患者中发现相比于化疗对照组患者具有临床获益。由此可见,在适应症的选择上精准匹配适用人群对于ADC的成功开发也至关重要。
另外,时至今日,随着技术的进步ADC不仅在结构上早已突破经典的抗体+连接子+载药模式,核素偶联药物(RDC)、小分子偶联药物(SMDC)、多肽偶联药物(PDC)、双环肽偶联药物、免疫刺激偶联药物(ISAC)、抗体偶联siRNA、细胞偶联抗体(AOC)、多弹头ADC等新概念ADC药物如雨后春笋般冒出来,而且在应用场景上已不再局限于治疗肿瘤,自身免疫疾病等其他适应症也成为新的开发热土。因而,掌握ADC平台型技术的企业可以发挥的空间非常大,将在这个领域大展拳脚。
写在最后
ADC是一个非常复杂的结构实体,CMC的可行性和难度对于最终能否开发出来一款成功的ADC药物起了决定性作用。正如每个人都有自己的能力圈,只能赚自己认知范围内的钱一样。对于ADC来说也是如此,不存在一款药物可以通吃绝大多数适应症也不仅仅只存在一种研发范式。不同的癌种微环境不同,靶标不同,选用何种抗体、载药、连接子、连接方式都不可能照搬其他癌种的做法,ADC研发的根本原则就是立足于适应症本身,实现安全性和有效性的有机统一,尽可能提高患者的治疗窗口。所以,泛偶联时代其他药企仍然可以走出一条差异化发展之路。充分发挥自身优势,遵循根本原则,满足未被满足的临床需求,只要在某一点上取得突破可能就会有惊喜。
参考资料:
-
创新药专题系列一——以古为镜,可以知兴替。后DS-8201时代,ADC药物从哪里来?到哪里去?(东亚前海证券)

